Chapitre 4 : Récepteurs nucléaires dans les voies de signalisation
4.1 Introduction
Les récepteurs nucléaires sont des facteurs de transcription qui jouent un rôle dans l’expression génique influençant des processus comme le métabolisme, la prolifération, l’équilibre électrolytique, la reproduction et l’inflammation (Lavery et McEwan, 2005; Mazaira G. I., 2018). En raison du rôle important qu’ils jouent dans un certain nombre d’activités physiologiques, les récepteurs nucléaires sont également la cible de la thérapeutique. Cette unité vise à décrire le mécanisme d’action des récepteurs nucléaires dans les voies de signalisation. Les aspects structurels et fonctionnels des récepteurs nucléaires seront décrits.
4.2 Résultats d’apprentissage du chapitre
À la fin de ce chapitre, vous pourrez :
- reconnaître les caractéristiques des ligands en ce qui a trait aux récepteurs nucléaires;
- décrire la structure des domaines des récepteurs nucléaires;
- définir les récepteurs nucléaires orphelins;
- décrire l’incidence de la phosphorylation sur les récepteurs nucléaires;
- comparer les récepteurs nucléaires à d’autres protéines réceptrices et les différencier les uns des autres.
4.3 Molécules de signalisation
4.3.1 Quelles sont les caractéristiques structurelles courantes des ligands qui ciblent les récepteurs nucléaires?
a. Ils possèdent des groupes aromatiques
b. Leur composition est principalement hydrophile
c. Leur composition est principalement hydrophobe
d. Options a et b
e. Options a et c
Les ligands qui ciblent les récepteurs nucléaires sont différents de ceux qui ciblent les récepteurs couplés aux enzymes ou les récepteurs couplés aux protéines G (abordés précédemment). Cela s’explique principalement par le fait que ces ligands sont relativement lipophiles et sont capables de traverser passivement la membrane cellulaire et de pénétrer dans le cytosol pour produire leurs effets. Les ligands des récepteurs couplés à des enzymes ou les RCPG sont soit trop gros, soit trop polaires et ne peuvent pas traverser la membrane cellulaire.
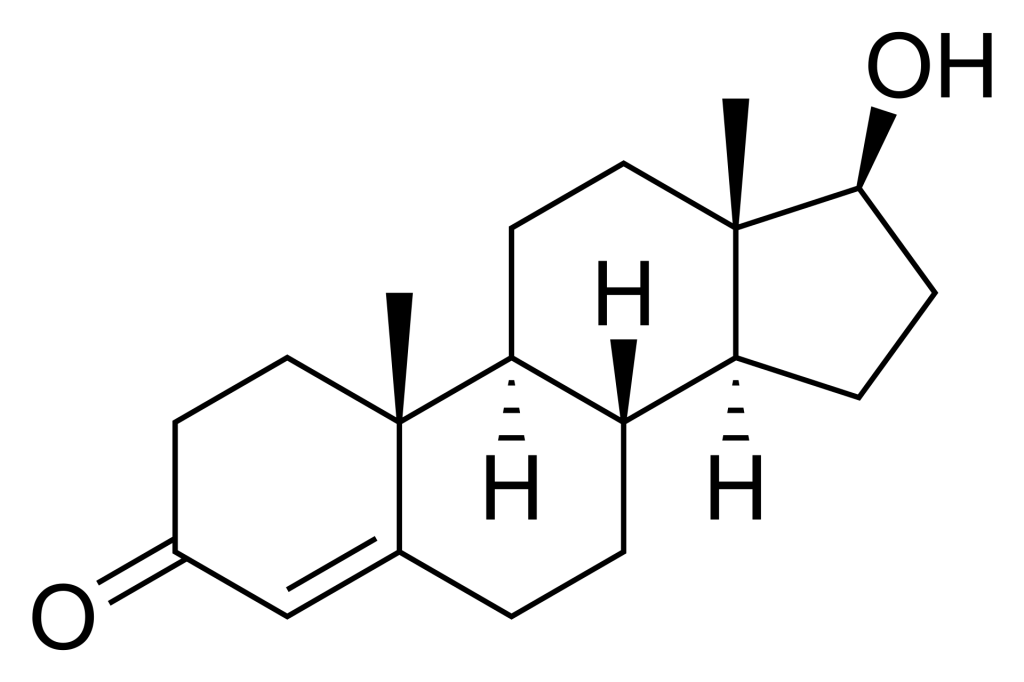
Par exemple, la testostérone est un ligand hormonal pour le récepteur nucléaire des androgènes. La testostérone se compose d’un anneau cyclopentanoperhydrophénanthrène (qui est le même noyau stéroïdien que le stérol commun, le cholestérol) (figure 4.1). La structure globale est relativement non polaire, à l’exception de deux atomes d’oxygène terminaux qui se situent à chaque extrémité de la molécule. Cela facilite la liaison de la testostérone à son récepteur nucléaire correspondant, car la pochette de liaison est relativement hydrophobe, à l’exception des chaînes latérales d’Arg752 et de Thr877, qui interagissent respectivement par liaison hydrogène avec les groupes fonctionnels carbonyle et hydroxyle de la testostérone (de Jésus-Tran et coll., 2006).
4.3.2 Quel est le mécanisme d’action général des récepteurs nucléaires qui répondent aux ligands dans une voie de signalisation?
a. Les ligands des récepteurs nucléaires agissent de manière similaire à ceux des récepteurs-enzymes en se liant dans la région extracellulaire et en produisant leurs effets.
b. Les ligands des récepteurs nucléaires traversent la bicouche lipidique de la membrane cellulaire et se lient aux molécules réceptrices pour former un complexe ligand-récepteur, après avoir pénétré dans le noyau.
Comme nous l’avons mentionné précédemment, les ligands qui activent les récepteurs nucléaires sont capables de traverser passivement la membrane cellulaire en raison de leur nature lipophile. Les récepteurs nucléaires se distinguent des autres récepteurs dans la mesure où ce sont des protéines intracellulaires (qui ne sont pas intégrées à la membrane cellulaire). On les appelle également « facteurs de transcription », car ils se lient à l’ADN et facilitent directement la transcription au moment de la liaison du ligand. En fait, les récepteurs nucléaires représentent la plus grande famille de facteurs de transcription eucaryotes (Mazaira G. I., 2018).
4.3.3 Quels sont les différents types de récepteurs nucléaires?
Il existe 48 récepteurs nucléaires répertoriés chez les êtres humains (Weikum et coll., 2018). Au cours des 50 dernières années, ces récepteurs ont été classés en différentes catégories en fonction de leur identification historique, de la similarité de leur séquence, de leur réponse au substrat du ligand, de leur dimérisation et de leurs éléments de liaison à l’ADN. Par exemple, les récepteurs nucléaires ont initialement été classés en trois types différents (récepteurs endocriniens, récepteurs orphelins et récepteurs orphelins adoptés), et il existe également des classifications fondées sur la similarité des séquences qui ont conduit à la création de six sous-familles (Laudet, 1997).
Habituellement, la classification la plus simple répertorie deux types de récepteurs nucléaires, appelés récepteurs de type I et de type II. Les récepteurs de type I sont situés dans le cytoplasme et transitent vers le noyau après la liaison de l’hormone. Les récepteurs des androgènes, de la progestérone et des glucocorticoïdes sont des exemples de récepteurs de type I. Les récepteurs de type II se trouvent dans le noyau et sont liés à l’ADN même en l’absence de ligand. Les récepteurs activés par les proliférateurs de peroxysomes (PPAR) et les récepteurs de l’acide rétinoïque (RAR) sont des exemples de récepteurs de type II.
4.3.4 Décrivez la structure des domaines canoniques des récepteurs nucléaires.
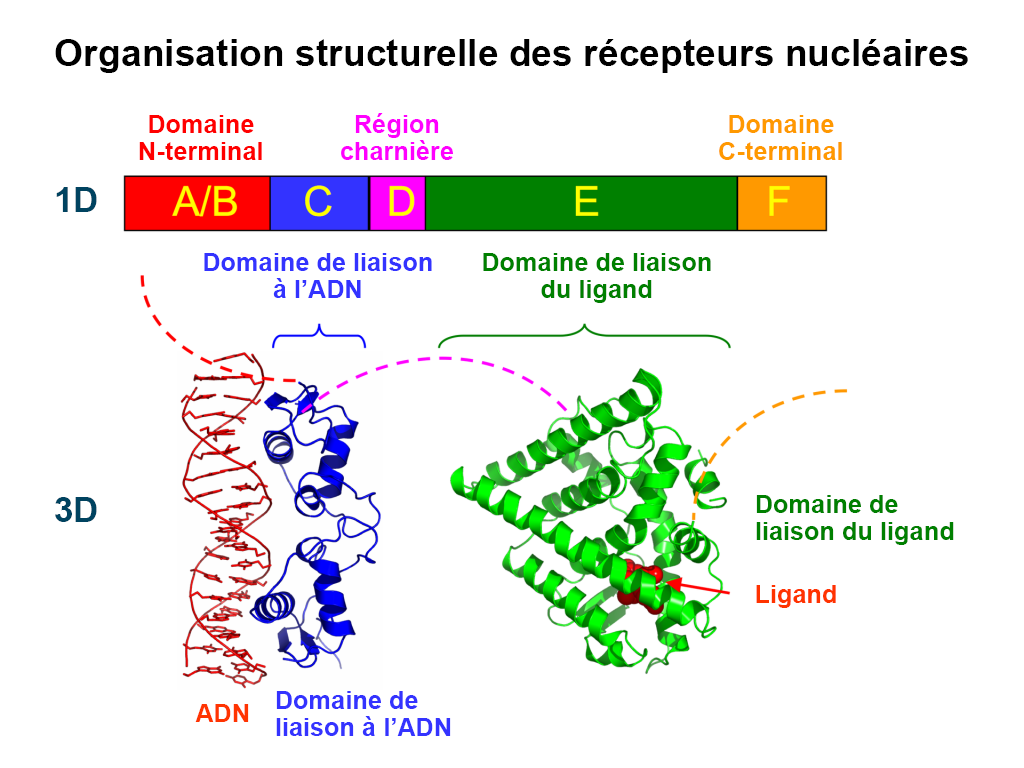
Différentes nomenclatures ont été utilisées pour désigner les récepteurs nucléaires. Dans le cas le plus générique, tous les récepteurs nucléaires contiennent une région de liaison à l’ADN et une région de liaison au ligand. Selon la séquence, les récepteurs nucléaires sont également désignés par les régions A à F (figure 4.2). Ces régions contiennent des domaines spécifiques qui jouent un rôle important sur le plan de l’activité. La région A/B, située à l’extrémité N-terminale, est très peu structurée et contient la fonction d’activation 1 (AF-1). La région C contient un domaine de liaison à l’ADN (DBD) qui joue un rôle important pour lier des séquences spécifiques de l’ADN et amorcer la transcription. La région D sert de boucle de connexion entre le DBD et la région E/F et est parfois appelée région charnière. La région E/F est située à l’extrémité C-terminale et abrite le domaine de liaison au ligand ainsi que le motif de la fonction d’activation 2 (AF-2).
Les DBD permettent aux récepteurs nucléaires de se lier à l’ADN dans des régions spécifiques appelées éléments de réponse. Le DBD contient également deux motifs en doigts de zinc. En plus des différents domaines, les récepteurs nucléaires possèdent différents signaux de localisation nucléaire (NLS) identifiés dans le domaine D (région charnière), qui facilitent la localisation cellulaire dans le noyau (Weikum et coll., 2018).
4.3.5 Où le ligand se lie-t-il aux récepteurs nucléaires?
Les ligands se lient à l’extrémité C-terminale des récepteurs nucléaires dans la région E/F ou le domaine de liaison du ligand (LBD). Cette liaison déclenche des changements conformationnels spécifiques dans l’ensemble du domaine de liaison du ligand. Plus précisément, ce domaine se compose de 12 hélices α et d’une pochette non polaire permettant la liaison du ligand (figure 4.2). La dernière hélice (H12) est repositionnée de manière à créer une structure plus condensée et une pochette de surface qui permet des interactions avec la région A/B ainsi qu’avec d’autres protéines corégulatrices. Cela favorise également la dimérisation du récepteur nucléaire, ce qui renforce encore davantage l’activation du récepteur.
4.3.6 Décrivez le cycle de liaison de l’hormone pour un cycle nucléaire de type I et de type II.
Pour les récepteurs de type I, la liaison du ligand se produit (dans le domaine de liaison du ligand) dans le cytosol après la diffusion de l’hormone à travers la membrane cellulaire. L’événement de liaison déclenche des changements conformationnels qui entraînent la dissociation des protéines stabilisatrices comme les protéines de choc thermique, ce qui permet également la dimérisation dans le cytosol. La dimérisation est facilitée par le DBD et le LBD. Les sites AF-1 et AF-2 se lient à d’autres protéines recrutées et qui permettent d’activer le récepteur nucléaire (p. ex., la famille des coactivateurs stéroïdiens Src/p160 – p160). Le complexe situé à l’intérieur du noyau se lie aux éléments de réponse des hormones pour amorcer la transcription (figure 4.3) (Feng et He, 2019).
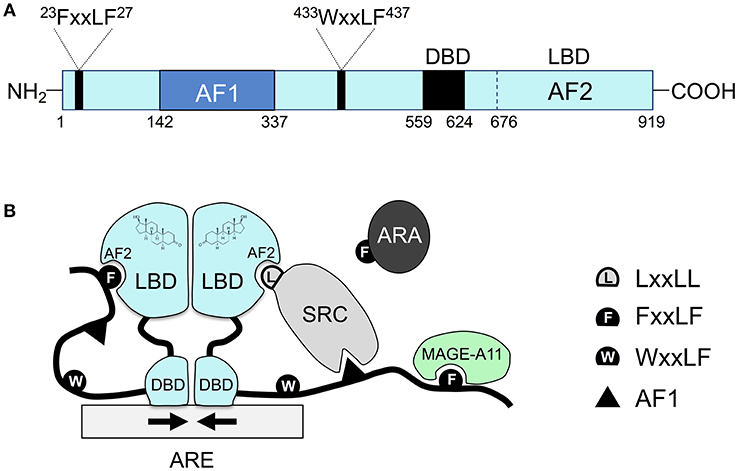
Les récepteurs de type II suivent une voie similaire, sauf que le récepteur nucléaire est toujours lié à l’ADN et forme généralement un complexe avec une protéine corépressive (Sever et Glass, 2013). La liaison du ligand (p. ex., une hormone) libère le corépresseur et active l’assemblage d’un coactivateur et de l’ARN polymérase, ce qui conduit finalement à la transcription des protéines cibles.
4.3.7 Quelle liaison de substrat est la plus attirée par un récepteur?
Imaginons une situation hypothétique dans laquelle un récepteur nucléaire présente différentes valeurs de Kd (constante de dissociation) pour différents ligands.
a. Kd = 0,5 nmol
b. Kd = 5 nmol
c. Kd = 50 nmol
La réaction d’une protéine (ou d’un récepteur) avec un ligand est exprimée par l’équation : P + L ↔ P-L.
La constante d’association (Ka) peut être exprimée quantitativement comme étant la concentration des produits divisée par la concentration des substrats. Cependant, les unités de cette réaction s’expriment en m-1, ce qui est difficile à comparer intuitivement. C’est pourquoi les constantes de dissociation sont couramment utilisées pour décrire les différentes réactions et fournir une valeur qui peut être facilement interprétée. La valeur de Kd représente la concentration requise pour que la moitié du récepteur ou de la protéine soit saturée. Par conséquent, une valeur de Kd inférieure correspond à un composé plus puissant, puisqu’une concentration plus faible est nécessaire pour interagir avec la cible. Fait important à noter, la constante de dissociation est l’inverse de la constante d’association. Ainsi, dans l’exemple ci-dessus, le substrat ayant une valeur de Kd = 0,5 nmol représente la plus grande affinité. Il importe de préciser que les différents substrats ou ligands peuvent avoir différentes valeurs de Kd pour différents récepteurs. Par exemple, l’estriol (un analogue de l’œstrogène) a une valeur de Kd environ deux fois moins élevée pour le récepteur d’œstrogène alpha que pour le récepteur d’œstrogène bêta (Dahlman-Wright et coll., 2003).
4.3.8 Quels éléments du cytosquelette permettent de transporter les récepteurs nucléaires liés à un ligand vers le noyau?
a. Microtubules
b. Microfilaments
c. Filaments intermédiaires
Les complexes ligand-récepteur nucléaire cytosoliques sont acheminés vers les pores nucléaires à l’aide des microtubules, qui constituent la principale voie de circulation (Gomperts et coll., 2009).
4.3.9 Que sont les récepteurs nucléaires orphelins?
Nous avons décrit différents types de récepteurs nucléaires. Dans la majorité de ces scénarios, le ligand et le récepteur ont été définis (p. ex., le cortisol, un stéroïde, se lie au récepteur des glucocorticoïdes). Cependant, il existe des récepteurs nucléaires dont le ligand demeure inconnu. Ces récepteurs nucléaires sont caractérisés comme étant des récepteurs orphelins, mais ils peuvent tout de même avoir une incidence sur les processus de transcription, en les activant ou en les réprimant (Gomperts et coll., 2009). Si le ligand est découvert ultérieurement, ces récepteurs sont mis à jour et deviennent des « récepteurs orphelins adoptés » (Li et coll., 2003). Par exemple, les récepteurs PPAR (alpha, gamma et delta) sont tous considérés comme étant des récepteurs orphelins adoptés puisqu’ils ont été initialement désignés comme des protéines critiques dans le métabolisme cellulaire. On a constaté qu’ils répondent à un certain nombre de substrats (p. ex., PPARα est activé par les acides gras libres) et qu’ils ont des effets pharmacologiques importants pour un certain nombre de maladies comme l’hyperlipidémie et le diabète.
4.3.10 La phosphorylation peut-elle réguler les récepteurs nucléaires?
Il a été démontré que les kinases phosphorylent les récepteurs nucléaires et modifient leur activité. Par exemple, la PKA et la MAPK peuvent phosphoryler les récepteurs nucléaires, ce qui démontre la diaphonie entre différentes voies biochimiques (Adams et coll., 1997; Tzagarakis-Foster et Privalsky, 1998). Bien que de nombreux sites différents aient été désignés comme cibles de la phosphorylation dans tous les domaines des récepteurs nucléaires, les résidus de sérine présents dans le domaine A/B sont des cibles communes.
4.3.11 La phosphorylation des récepteurs nucléaires favorise-t-elle ou réprime-t-elle la transcription?
La phosphorylation peut avoir pour effet de favoriser ou de réprimer la transcription. Dans une situation où la phosphorylation permet la liaison des coactivateurs, la transcription serait régulée à la hausse. Cependant, la transcription serait inhibée si la phosphorylation empêche la dimérisation du récepteur (Dongsheng Chen Paul E. Pace et Ali, 1999). Par exemple, la phosphorylation de l’adrénorécepteur par la PKA favorise l’activation dépendante et indépendante du ligand, tandis que la phosphorylation du récepteur alpha des œstrogènes par la PKA peut réduire la dimérisation et la liaison à l’ADN. Toutefois, la phosphorylation de différents sites du récepteur alpha des œstrogènes par d’autres kinases (comme la MAPK) peut favoriser l’activation. Par conséquent, les effets de la phosphorylation de l’activité des récepteurs nucléaires sont complexes et difficiles à prévoir.
4.3.12 Comparez certaines propriétés des récepteurs nucléaires à celles des récepteurs couplés à des enzymes et des RCPG, et les différencier.
Les récepteurs nucléaires se distinguent des autres types de récepteurs par de multiples caractéristiques. Voici quelques-uns des points clés :
- Les récepteurs nucléaires se trouvent dans le cytosol ou le noyau, tandis que les récepteurs couplés à des enzymes et les RCPG se situent exclusivement dans la membrane cellulaire.
- Les récepteurs nucléaires stimulent directement la transcription et se lient à l’ADN, alors que les récepteurs couplés à des enzymes modifient l’activité de la kinase et que les RCPG modulent les fonctions enzymatiques ou de transport.
- Sur le plan structurel, les récepteurs nucléaires ont une structure monomérique avec des domaines distincts de liaison du ligand et de liaison à l’ADN qui effectueront une homodimérisation ou une hétérodimérisation pour entraîner l’activation. Les récepteurs couplés à des enzymes possèdent une seule hélice transmembranaire intégrée dans la membrane cellulaire qui relie un domaine de liaison du ligand au domaine kinase intracellulaire. Les RCPG possèdent sept hélices transmembranaires qui relient le site de liaison du ligand au domaine couplé aux protéines G.
Bibliographie
Adams, M., Reginato, M. J., Shao, D., Lazar, M. A., et Chatterjee, V. K. (1997). Transcriptional activation by peroxisome proliferator-activated receptor gamma is inhibited by phosphorylation at a consensus mitogen-activated protein kinase site. The Journal of Biological Chemistry, 272(8), 5128-5132. https://www.jbc.org/article/S0021-9258(19)79350-8/fulltext
Dahlman-Wright, K., Koehler, K., et Gustafsson, J.-Å. (2003). Estrogen Receptor-β Structure and Function. In H. L. Henry et A. W. Norman (éd.), Encyclopedia of Hormones (599-608). Academic Press. https://doi.org/10.1016/B0-12-341103-3/00091-7
de Jésus-Tran, K., Côté, P.-L., Cantin, L., Blanchet, J., Labrie, F., et Breton, R. (2006). Comparison of crystal structures of human androgen receptor ligand-binding domain complexed with various agonists reveals molecular determinants responsible for binding affinity. Protein Science, 15(5), 987-999. https://doi.org/10.1110/ps.051905906
Dongsheng Chen Paul E. Pace, R. C. C., et Ali, S. (1999). Phosphorylation of Human Estrogen Receptor α by Protein Kinase A Regulates Dimerization. Molecular and Cellular Biology, 19(2), 1002-1015. https://doi.org/10.1128/MCB.19.2.1002
Feng, Q., et He, B. (2019). Androgen Receptor Signaling in the Development of Castration-Resistant Prostate Cancer. Frontiers in Oncology, 9. https://doi.org/10.3389/fonc.2019.00858
Gomperts, B. D., Kramer, I. M., et Tatham, P. E. R. (2009). Signal transduction . In Signal transduction (2e éd.). Elsevier/Academic Press.
Laudet, V. (1997). Evolution of the nuclear receptor superfamily: early diversification from an ancestral orphan receptor. Journal of Molecular Endocrinology, 19(3), 207-226. https://doi.org/10.1677/jme.0.0190207
Lavery, D. N., et McEwan, I. J. (2005). Structure and function of steroid receptor AF1 transactivation domains: induction of active conformations. In Biochemical journal (vol. 391, no 3). Portland Press Ltd. https://doi.org/10.1042/bj20050872
Li, Y., Lambert, M. H., et Xu, H. E. (2003). Activation of Nuclear Receptors: A Perspective from Structural Genomics. Structure, 11(7), 741-746. https://doi.org/10.1016/S0969-2126(03)00133-3
Mazaira GI, Zgajnar NR, Lotufo CM, Daneri-Becerra C, Sivils JC, Soto OB, Cox MB, G. M. (2018). The Nuclear Receptor Field: A Historical Overview and Future Challenges. Nuclear Receptor Research. https://doi.org/10.11131/2018/101320
Sever, R., et Glass, C. K. (2013). Signaling by nuclear receptors. Cold Spring Harbor Perspectives in Biology, 5(3), a016709-a016709. https://doi.org/10.1101%2Fcshperspect.a016709
Tzagarakis-Foster, C., et Privalsky, M. L. (1998). Phosphorylation of Thyroid Hormone Receptors by Protein Kinase A Regulates DNA Recognition by Specific Inhibition of Receptor Monomer Binding. The Journal of Biological Chemistry, 273(18), 10926-10932. https://doi.org/10.1074/jbc.273.18.10926
Tzavlaki, K., et Moustakas, A. (2020). TGF-β signaling. Biomolecules (Basel, Switzerland), 10(3), 487. https://doi.org/10.3390/biom10030487
Weikum, E. R., Liu, X., et Ortlund, E. A. (2018). The nuclear receptor superfamily: A structural perspective. In Protein Science (vol. 27, no 11, 1876-1892). https://doi.org/10.1002/pro.3496

